Химические источники тока представляют собой устройства, в которых энергия химических реакций преобразуется в электрическую энергию. К химическим источникам тока относятся гальванические элементы и аккумуляторы.
Прохождение тока через жидкие проводники. В жидких проводниках (электролитах) происходит процесс электролитической диссоциации, т. е. непрерывный самопроизвольный распад молекул на составные части. Например, при растворении медного купороса CuS04 в воде его молекулы распадаются на положительные ионы меди Си и отрицательные ионы S04 (так называемый кислотный остаток). В электролите происходит беспорядочное движение ионов и молекул: ионы соединяются, образуют молекулы, вновь распадаются и т. д. В целом такой раствор является электрически нейтральным, так как в нем содержится одинаковое количество положительных и отрицательных ионов. Однако если жидкий проводник, например раствор медного купороса, поместить в электрическое поле (рис. 155), созданное при помощи двух электродов — заряженных медных пластин — анода 2 и катода 3, то на положительные и отрицательные ионы начнут действовать электрические силы. При этом положительно заряженные ионы меди Сu+ устремятся к пластине, соединенной с отрицательным полюсом источника тока (катоду 3), а отрицательно заряженные ионы кислотного остатка SO4— к пластине, соединенной с положительным полюсом источника тока (аноду 2). Это упорядоченное движение ионов представляет собой электрический ток в жидких проводниках. Следовательно, ток в жидких проводниках существенно отличается от тока в металлах, так как вместо легких электронов здесь движутся в тысячи и десятки тысяч раз более тяжелые положительные и отрицательные ионы.
 Рис. 155. Схема прохождения электрического тока через электролит: 1 — электролит; 2 — анод; 3 — катод; 4 — источник электрической энергии
Рис. 155. Схема прохождения электрического тока через электролит: 1 — электролит; 2 — анод; 3 — катод; 4 — источник электрической энергии
Возникновение э. д. с. в гальваническом элементе. Простейший медно-цинковый гальванический элемент Вольта (рис. 156) состоит из двух пластин (электродов): цинковой 2 (катода) и медной 1 (анода), опущенных в электролит 3, представляющий собой водный раствор серной кислоты H2S04. При растворении серной кислоты в воде происходит процесс электролитической диссоциации, т. е. часть молекул кислоты распадается на положительные ионы водорода H2+ и отрицательные ионы кислотного остатка S04-. Одновременно происходит растворение цинкового электрода в серной кислоте. При растворении этого электрода положительные ионы цинка Zn+ переходят в раствор и соединяются с отрицательными ионами SO4- кислотного остатка, образуя нейтральные молекулы сернокислого цинка ZnS04. При этом на цинковом электроде будут скапливаться оставшиеся свободные электроны, вследствие чего этот электрод приобретает отрицательный заряд. В электролите же образуется положительный заряд ввиду нейтрализации части отрицательных ионов S04. Таким образом, в пограничном слое между цинковым электродом и электролитом возникает некоторая разность потенциалов и создается электрическое поле, которое препятствует дальнейшему переходу положительных ионов цинка в электролит; при этом растворение цинкового электрода прекращается. Медный электрод практически не растворяется в электролите и приобретает тот же положительный потенциал, что и электролит. Разность потенциалов медного ?Сu и цинкового ?Zn электродов при разомкнутой внешней цепи представляет собой э. д. с. Е рассматриваемого гальванического элемента.
Э. д. с, создаваемая гальваническим элементом, зависит от химических свойств электролита и металлов, из которых выполнены электроды. Обычно подбирают такие комбинации металлов и электролита, при которых э. д. с. наибольшая, однако почти во всех применяемых элементах она не превышает 1,1 —1,5 В.
При подключении к электродам гальванического элемента какого-либо приемника электрической энергии (см. рис. 156) по внешней цепи начнет протекать ток I от медного электрода (положительный полюс элемента) к цинковому (отрицательный полюс). В электролите в это время начнется движение положительных ионов цинка Zn+ и водорода Н2+ от цинковой пластины к медной и отрицательных ионов кислотного остатка S04- от медной пластины к цинковой. В результате нарушится равновесие электрических зарядов между электродами и электролитом, вследствие чего в электролит с катода снова начнут поступать положительные ионы цинка, поддерживая на этом электроде отрицательный заряд; на медном же электроде будут осаждаться новые положительные ионы. Таким образом, между анодом и катодом все время будет существовать разность потенциалов, необходимая для прохождения тока по электрической цепи.
 Рис. 156. Устройство медно-цинкового гальванического элемента
Рис. 156. Устройство медно-цинкового гальванического элемента
 Рис. 157. Устройство сухого угольно-цинкового гальванического элемента: 1—газоотводная трубка; 2— смоляная заливка; 3 — деполяризатор; 4 — угольный электрод; 5 — картонный футляр; 6 — тестообразная паста (сухой электролит); 7 — цинковый электрод
Рис. 157. Устройство сухого угольно-цинкового гальванического элемента: 1—газоотводная трубка; 2— смоляная заливка; 3 — деполяризатор; 4 — угольный электрод; 5 — картонный футляр; 6 — тестообразная паста (сухой электролит); 7 — цинковый электрод
Поляризация. Рассмотренный гальванический элемент Вольта не может длительно работать вследствие возникающего в нем вредного явления поляризации. Сущность этого явления заключается в следующем. Положительные ионы водорода Н2+, направляющиеся к медному электроду 1, взаимодействуют с имеющимися на нем свободными электронами и превращаются в нейтральные атомы водорода. Эти атомы покрывают поверхность медного электрода сплошным слоем 4, что ухудшает работу гальванического элемента по двум причинам. Во-первых, между слоем водорода и электролитом возникает дополнительная э. д. с. (э. д. с. поляризации), направленная против основной э. д. с. элемента, поэтому его результирующая э. д. с. Е уменьшается. Во-вторых, слой водорода отделяет медный электрод от электролита и препятствует подходу к нему новых положительных ионов. При этом резко возрастает внутреннее сопротивление гальванического элемента.
Для борьбы с поляризацией во всех гальванических элементах вокруг положительного электрода располагают специальные вещества — деполяризаторы, которые легко вступают в химическую реакцию с водородом. Они поглощают подходящие к положительному электроду ионы водорода, не позволяя им осаждаться на этом электроде.
Промышленность выпускает гальванические элементы различных типов (с различными электродами и электролитами), имеющие разное конструктивное выполнение. Наиболее распространены угольно-цинковые элементы, в которых угольный и цинковый электроды погружены в водный раствор хлористого аммония (нашатыря) или поваренной соли, а в качестве деполяризатора применяется перекись марганца.
Сухие элементы. Разновидностью гальванического элемента является сухой элемент (рис. 157), применяемый в батареях карманных элек-трофонарей, радиоприемниках и пр. В этом элементе жидкий электролит заменен тестообразной массой, состоящей из раствора нашатыря, смешанного с древесными опилками и крахмалом, а цинковый электрод выполнен в виде цилиндрической коробки, используемой в качестве сосуда, в котором помещают электролит и угольный электрод. Для отвода газов, образующихся при работе элемента, в нем предусматривают газоотводную трубку.
Емкость. Способность химических источников тока отдавать электрическую энергию характеризуется их емкостью. Под емкостью понимают количество электричества, запасенного в гальванических элементах или аккумуляторах. Емкость измеряется в ампер-часах. Номинальная емкость химического источника тока равна произведению номинального (расчетного) разрядного тока (в амперах), отдаваемого химическим источником тока при подключении к нему нагрузки, на время (в часах) до того момента, пока его э. д. с. не достигнет минимально допустимого значения. При длительной работе количество электроэнергии, которое может отдать гальванический элемент, уменьшается, так как постепенно расходуются имеющиеся в нем активные химические вещества, обеспечивающие возникновение э. д. с; при этом уменьшаются э. д. с. элемента и его емкость и возрастает его внутреннее сопротивление.
Гальванический элемент обладает номинальной емкостью только в том случае, если после его изготовления прошло сравнительно небольшое время. Емкость гальванического элемента постепенно уменьшается, даже если он не отдает электрической энергии (после 10—12 месяцев хранения емкость сухих элементов уменьшается на 20—30 %). Это объясняется тем, что химические реакции в таких элементах протекают непрерывно и запасенные в них активные химические вещества все время расходуются.
Уменьшение емкости химических источников тока с течением времени называются саморазрядом. Емкость гальванического элемента снижается также при разряде его большим током.
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от
 Рис. 158. Заряд (а) и разряд (б) аккумулятора
Рис. 158. Заряд (а) и разряд (б) аккумулятора
постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных— порошок , перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемыерасширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
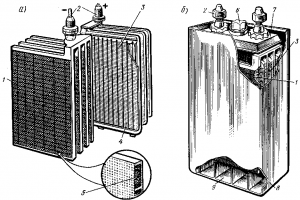 Рис. 159. Устройство пластин (а) и общий вид (б) кислотного аккумулятора: 1 — блок намазных отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
Рис. 159. Устройство пластин (а) и общий вид (б) кислотного аккумулятора: 1 — блок намазных отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя
 Рис. 160. Прохождение через электролит положительных и отрицательных ионов при разряде (а) и заряде (б) кислотного аккумулятора
Рис. 160. Прохождение через электролит положительных и отрицательных ионов при разряде (а) и заряде (б) кислотного аккумулятора
пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04- со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04- — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
PbO2 + Pb + 2H2SO4 ? 2PbSO4 + 2H2O
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при
 Рис. 161. Кривые напряжения кислотного аккумулятора при заряде и разряде
Рис. 161. Кривые напряжения кислотного аккумулятора при заряде и разряде
неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
В тех случаях, когда ток и напряжение отдельного источника электрической энергии (в том числе аккумулятора) являются недостаточными для нормальной работы электрических потребителей, применяют последовательное, параллельное и смешанное соединения таких источников.
Последовательное соединение. При последовательном соединении аккумуляторов отрицательный электрод первого аккумулятора соединяют с положительным электродом второго, отрицательный электрод второго — с положительным электродом третьего и т. д. (рис. 165, а). Нагрузку (приемник) присоединяют к положительному электроду первого и отрицательному электроду последнего аккумулятора.
При последовательном соединении аккумуляторов их электродвижущие силы согласно второму закону Кирхгофа складываются и результирующая э. д. с. равна сумме э. д. с. отдельных аккумуляторов. Следовательно, чем больше аккумуляторов включено в цепь, тем больше напряжение, под которым находятся приемники (рис. 166).
Эквивалентное внутреннее сопротивление последовательно соединенных аккумуляторов равно сумме их внутренних сопротивлений.
Аккумуляторные батареи составляются из ряда совершенно одинаковых аккумуляторов. При этом на заводе их подбирают
 Рис. 165. Последовательное (а) и параллельное (б) соединения аккумуляторов
Рис. 165. Последовательное (а) и параллельное (б) соединения аккумуляторов
 Рис. 166. Напряжение, приложенное к приемнику, при различном числе последовательно соединенных аккумуляторов
Рис. 166. Напряжение, приложенное к приемнику, при различном числе последовательно соединенных аккумуляторов
так, чтобы все они имели одинаковые э. д. с. E = Eak и одинаковое внутреннее сопротивление Rak. Поэтому для батареи, состоящей из п аккумуляторов,
E = nEak; Rэкв= nRak
Параллельное соединение. При параллельном соединении все положительные электроды отдельных аккумуляторов соединяют вместе, и они образуют положительный полюс; все отрицательные электроды отдельных аккумуляторов также соединяют вместе, и они образуют общий отрицательный полюс (рис. 165,б). Нагрузку (приемник) присоединяют к общим отрицательному и положительному полюсам. При этом все аккумуляторы будут находиться под одинаковым напряжением U, а общий ток I равен сумме токов, отдаваемых отдельными аккумуляторами. При параллельном соединении п одинаковых аккумуляторов э. д. с. батареи E = Eak; ее внутреннее сопротивление R = Rak /n и ток I = nIak.
Смешанное соединение. В тех случаях, когда аккумуляторы не обеспечивают возможности получения необходимого тока и напряжения, применяют последовательно-параллельное (смешанное) их соединение (рис. 167). В данном случае в каждой из двух параллельных групп аккумуляторной батареи имеется по два последовательно соединенных аккумулятора.
Аккумуляторные батареи в большинстве случаев составляются из последовательно соединенных аккумуляторов. Смешанное и параллельное соединения аккумуляторов применяют редко, так
 Рис. 167. Смешанное соединение аккумуляторов
Рис. 167. Смешанное соединение аккумуляторов
как в этих случаях трудно обеспечить равномерное распределение тока между параллельными ветвями. Равенство токов I1 и I2 в отдельных ветвях будет иметь место только в том случае, если будут равны э. д. с. Е1 и Е2, действующие в этих ветвях, и их внутренние сопротивления Rэк1 = Rэк2.